La propagation alarmante du virus du SRAS-CoV-2 nécessite de trouver les bonnes mesures pour prévenir et combattre la pandémie de coronavirus (COVID) -19. 1 Les chercheurs ont identifié l’enzyme de conversion de l’angiotensine II (ACE2) comme le récepteur probable avec lequel le SRAS-CoV-2 infecte les cellules humaines. 2 , 3 Des découvertes récentes suggèrent que l’ACE2 est fortement exprimé dans la cavité buccale 3 et des concentrations détectables de virus ont été trouvées dans la salive. 4 , 5Par conséquent, le virus peut pénétrer principalement dans l’organisme par la muqueuse buccale. La maladie des gencives (parodontite) est connue pour provoquer une ulcération de l’épithélium gingival et affaiblir la fonction protectrice de la muqueuse buccale. On peut supposer que cette surface ulcérée exposée augmente le risque d’invasion par le SRAS-CoV-2.
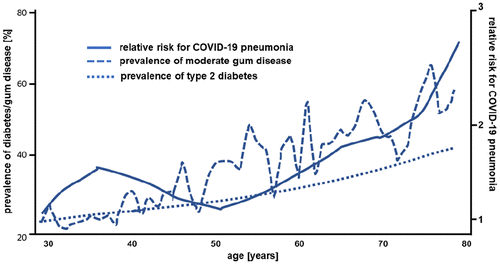
Les analyses actuelles en population des cours sévères de COVID-19 en Chine 6 montrent une corrélation claire avec l’âge plus élevé, qui est similaire à la corrélation entre l’âge et la prévalence de la parodontite, et également similaire à la corrélation bien connue entre l’âge et prévalence du diabète ( figure 1). 7 , 8 Une autre indication est les statistiques actuelles de mortalité COVID-19 dans lesquelles les pays européens sans consultations et traitements d’hygiène bucco-dentaire réguliers et soutenus par l’État (comme la Belgique, l’Italie et l’Espagne), avec des infrastructures et des niveaux de vie comparables, ont des niveaux de vie significativement plus élevés. taux de mortalité pour un million d’habitants (état au 2 avril 2020: 606, 490 et 436, respectivement) que dans les pays disposant de programmes d’hygiène bucco-dentaire bien établis (comme l’Allemagne: 71, l’Autriche: 61 ou la Norvège: 38 9 ).
Le diabète est un facteur de risque de maladie des gencives et il est nécessaire de prêter attention aux complications buccales possibles dans les premiers stades. La Fédération internationale du diabète (FID) 10 recommande que les dépistages réguliers du diabète soient complétés par une évaluation annuelle de la cavité buccale pour les maladies des gencives, y compris les saignements lors du brossage ou l’inspection de l’enflure. L’hyperglycémie endommage le tissu conjonctif dans la cavité buccale avec une synthèse réduite des fibroblastes gingivaux, entraînant la perte des fibres parodontales et de l’os alvéolaire. 11De plus, une altération de l’activité phagocytaire des cellules mononucléaires et polymorphonucléaires a été observée, conduisant au développement d’une flore sous-gingivale pathogène agressive. L’infection parodontale peut donc induire une inflammation systémique, qui à son tour développe ou renforce la résistance chronique à l’insuline. Un cercle vicieux d’hyperglycémie, de parodontite et de dégradation du tissu conjonctif, d’inflammation (orale et systémique) et de résistance à l’insuline se développe, ce qui est pratiquement incontrôlable pour tous les troubles sans intervention efficace. 11
Une étude à long terme récemment publiée a fourni des preuves impressionnantes de la valeur des soins bucco-dentaires dans la prévention primaire de la pneumonie chez les personnes atteintes de diabète. Les enquêteurs ont analysé cette association sur 98 800 personnes à Taïwan sur une période de 12 ans. Les auteurs ont conclu que les patients ayant reçu un traitement parodontal intensif avaient un risque moyen de 66% de pneumonie en moins. Les patients diabétiques avaient un risque accru de 78% de développer une pneumonie par rapport au groupe témoin. 12 Ces résultats indiquent que le patient multimorbide atteint de diabète et de parodontite en tant que comorbidité présente un risque effroyablement élevé de pneumonie même sans infection par le SRAS-CoV-2.
L’association entre le diabète et l’augmentation de la mortalité par COVID-19 peut être liée aux aspects décrits ci-dessus mais également aux effets systémiques supplémentaires de la parodontite. La maladie parodontale affecte la glycémie et altère le système immunitaire inné. La parodontite augmente également l’inflammation systémique, car les médiateurs dérivés de l’hôte de la maladie parodontale et de la destruction des tissus (par exemple, les cytokines et les métalloprotéinases) sont libérés du tissu parodontal enflammé dans le système circulatoire. 13 On sait que les patients diabétiques ont un risque accru de mortalité par maladies bucco-dentaires concomitantes, tandis que les patients atteints de parodontite ont un risque manifestement plus élevé de diabète. 14Dans ce contexte, des biomarqueurs tels que la Métalloprotéinase matricielle MMP8 (disponible en laboratoire ou en test rapide de salive) offrent la possibilité d’identifier les patients à risque de diabète et ainsi de la rendre accessible pour une prévention ciblée. 15 , 16
Une barrière épithéliale gingivale qui fonctionne bien peut aider à empêcher les virus et bactéries pathogènes dans la cavité buccale de pénétrer dans la circulation sanguine. Cela signifie qu’un brossage dentaire quotidien régulier avec une application supplémentaire de rince-bouche désinfectant jusqu’au pharynx postérieur, en particulier chez les patients diabétiques, pourrait potentiellement aider à réduire les conséquences systémiques potentielles d’une infection par le virus du SRAS-CoV-2. Le dentiste et le spécialiste du diabète devraient conseiller aux patients diabétiques de subir des bilans de santé réguliers et des traitements d’hygiène dentaire. 17 , 18 Cette stratégie de prévention ciblée, avec des recommandations supplémentaires pour surveiller et maintenir la santé bucco-dentaire, peut être une approche rapide et simple de la protection contre la pandémie actuelle de coronavirus. COVID-19 ne s’arrête pas aux frontières; il s’agit d’un défi mondial et les solutions à cette pandémie nécessiteront une alliance interdisciplinaire d’experts dans tous les domaines, y compris la dentisterie, la parodontologie et la diabétologie.
References
1. The Lancet . COVID-19: too little, too late? Lancet. 2020;395:755.
Google Scholar | Crossref | Medline
2. Zhou, P, Yang, XL, Wang, XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020;579:270-273.
Google Scholar | Crossref | Medline
3. Xu, H, Zhong, L, Deng, J, et al. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int J Oral Sci. 2020;12:8.
Google Scholar | Crossref | Medline
4. Chen, L, Zhao, J, Peng, J, et al. Detection of 2019-nCoV in saliva and characterization of oral symptoms in COVID-19 patients [published online ahead of print March 19, 2020]. SSRN. Available at: https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3557140
Google Scholar
5. To, KKW, Tsang, OTY, Yip, CCY, et al. Consistent detection of 2019 novel coronavirus in saliva [published online ahead of print February 12, 2020]. Clin Infect Dis. doi:10.1093/cid/ciaa149. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7108139/
Google Scholar
6. Sun, K, Chen, J, Viboud, C. Early epidemiological analysis of the coronavirus disease 2019 outbreak based on crowdsourced data: a population-level observational study Lancet Digital Health. 2020;2:e201-e208.
Google Scholar | Crossref | Medline
7. Thornton-Evans, G, Eke, P, Wie, L, et al. Periodontitis among adults aged ≥30 years — United States, 2009–2010. MMWR Morb Mortal Wkly Rep. 2013;62:129-135.
Google Scholar
8. Cheng, YJ, Imperatore, G, Geiss, LS, et al. Secular changes in the age-specific prevalence of diabetes among U.S. adults: 1988–2010. Diabetes Care. 2013;36:2690-2696.
Google Scholar | Crossref | Medline | ISI
9. Statista. Coronavirus (COVID-19) deaths worldwide per one million population as of April 26 , 2020, by country. Available at https://www.statista.com/statistics/1104709/coronavirus-deaths-worldwide-per-million-inhabitants/
Google Scholar
10. Skamagas, M, Breen, TL, LeRoith, D. Update on diabetes mellitus: prevention, treatment, and association with oral diseases. Oral Dis. 2008;14:105-114.
Google Scholar | Crossref | Medline
11. Janket, SJ, Jones, JA, Meurman, JH, Baird, AE, Van Dyke, TE. Oral infection, hyperglycemia, and endothelial dysfunction. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008; 105:173-179.
Google Scholar | Crossref | Medline
12. Yang, LC, Suen, YJ, Wang, YH, Lin, TC, Yu, HC, Chang, YC. The association of periodontal treatment and decreased pneumonia: a nationwide population-based cohort study. Int J Environ Res Public Health. 2020;17:3356.
Google Scholar
13. Hajishengallis, G . Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol. 2015;15:30-44.
Google Scholar | Crossref | Medline | ISI
14. Sanz, M, Ceriello, A, Buysschaert, M, et al. Scientific evidence on the links between periodontal diseases and diabetes: consensus report and guidelines of the joint workshop on periodontal diseases and diabetes by the International diabetes Federation and the European Federation of Periodontology. Diabetes Res Clin Pract. 2018;137:231-241.
Google Scholar | Crossref | Medline
15. Sorsa, T, Alassiri, S, Grigoriadis, A, et al. Active MMP-8 (aMMP-8) as a grading and staging biomarker in the periodontitis classification. Diagnostics (Basel). 2020;10:E61.
Google Scholar | Crossref | Medline
16. Grigoriadis, A, Sorsa, T, Räisänen, I, Pärnänen, P, Tervahartiala, T, Sakellari, D. Prediabetes/diabetes can be screened at the dental office by a low-cost and fast chair-side/point-of-care aMMP-8 Immunotest. Diagnostics (Basel) 2019;9:E151.
Google Scholar | Crossref | Medline
17. Chi, AC, Neville, BW, Krayer, JW, Gonsalves, WC. Oral manifestations of systemic disease. Am Fam Physician. 2010;82:1381-1388.
Google Scholar | Medline | ISI
18. Kiran, M, Arpak, N, Unsal, E, Erdoǧan, MF. The effect of improved periodontal health on metabolic control in type 2 diabetes mellitus. J Clin Periodontol. 2005;32:266-272.
Google Scholar | Crossref | Medline
View Abstract